EJERCICIO 3:
-REACCIÓN 1: Vinagre es ácido ácetico diluído
CH3-COOH
Bicarbonato es hidrógenocarbonato de sodio:
NaHCO3
Es una reacción ácido-base. Se obtiene acetato de sodio y un hipotético ácido carbónico que se descompone como dióxido de carbono (gas que burbujea) y agua:
CH3COOH + NaHCO3 = CH3COONa + CO2 + H2O
-REACCIÓN 2: Si agregamos agua oxigenada (Peroxido de Oxigeno H2O2) a una papa sin cocer, la catalasa separara el Oxigeno del Peroxido de Oxigeno, liberando una gran cantidad de gas (O2 - oxigeno).
Si al agregar el Peroxido de Oxigeno a una papa cocinada no pasara nada, debido a que la enzima estara desnaturalizada, es decir, debido al calor la catalasa perdera sus propiedades antioxidantes.
-REACCIÓN 3: Al agregar zinc fragmentado conforme lo vas depositando en el frasco de HCl, va reaccionando, esa reacción se llama oxido reducción. Lo que sucede es que el Zn va convirtiendose a una sal ZnCl y al mismo tiempo libera H2, ese efecto que sucede de presipitarse subir y lugo volver a presipitarse es debido a la conversión de los materiales y a la liberación de H2, toma en cuenta que el Zn tien una densidad distinta a la del HCl por eso se va al fondo.
También mientras reacciona libra H2 un gas de menor densidad del HCl y luego obtienes ZnCl una sal con densidad diferente al HCl y además soluble en este.
Finalmente en una hoja de datos de seguridad MSDS del H2 busca su punto de inflamabilidad, explosividad, etc, Debes entender primero el significado de inflamabilidad:
Gas inflamable: Es aquel que tiene un rango inflamable con el aire a 20ºC y presión de referencia de 101.3 kPa, entre otros, propano, hidrógeno, butano, pentano y etano.
En resumen el H2 tiene una predisposición química debida a su configuración electronica para reaccionar con el O2, a temperatura ambiente, que significa que requiere de muy poca energía para sufrir una reacción de oxidación, que no es otra cosa mas que quemarse en presencia de O2 a temperatura ambiente.
-REACCIÓN 4: Mas que combustion, lo correcto sería hablar de oxidación
2 Mg +O2 -> 2 MgO
Es una redox formada por las siguientes semireacciones
Oxidación: 2 Mg -> 2 Mg+2 + 4 e-
Reducción: O2 +4 e - -> 2 O + 4 e- -> 2 O-2
Los elementos puros tienen estado de oxidación 0
El único estado de oxidación positivo que puede tomar el magnesio y todos los elementos del grupo IIA (2) es +2, por eso cada átomo de magnesio pierde 2 electrones. Luego cada átomo de oxígeno toma 2 electrones, los mismos que perdio el magnesio.
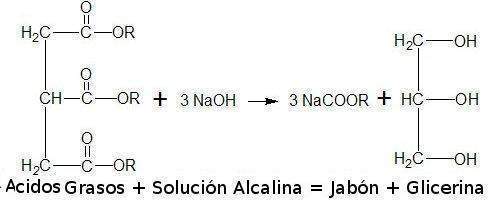
-REACCIÓN 5: Podríamos definir la saponificación como el proceso que convierte "mágicamente" la grasa o el aceite, en jabón limpiador. Esta transformación mágica no es otra cosa que una reacción química muy común, y que consiste básicamente en:
ÁCIDOS GRASOS + SOLUCIÓN ALCALINA = JABÓN + GLICERINA
Así es como al mezclar los ácidos grasos (principales componentes de las grasas animales y de los aceites vegetales) con una solución alcalina (hecha a partir de una mezcla de agua y un álcali, como por ejemplo la sosa), se obtiene el jabón (que será realmente suave, porque además el otro subproducto que se obtiene de esta reacción es la glicerina).
El álcali es imprescindible para que se produzca esa reacción, pero hay que tener en cuenta que por sí solo es un elemento cáustico muy peligroso, cuyo manejo implica tomar una serie de precauciones muy importantes para manipularlo con seguridad. Los álcalis más utilizados en la fabricación del jabón son la sosa (hidróxido sódico, NaOH) y la potasa (hidróxido potásico, KOH).
Por eso, es necesario tener mucha experiencia y unos conocimientos muy amplios sobre los álcalis y sus reacciones químicas, para proceder a realizar una saponificación que ofrezca totales garantías de que el producto final obtenido no entrañe riesgo alguno para la piel.
Esto no significa que la saponificación sea un proceso terriblemente peligroso, sino más bien muy delicado de realizar: Así, por ejemplo, si en la reacción anterior hay un exceso de sosa, el producto resultante será una masa cáustica inservible; mientras que si por el contrario, la cantidad de sosa es insuficiente, el producto resultante será una mezcla grumosa de aceites, que en nada se parecerá tampoco al jabón.
Es por eso que para realizar un buen jabón, perfectamente saponificado, y con unas excelentes cualidades limpiadoras y emolientes, aparte de una gran experiencia y conocimientos de la saponificación, se necesita conocer también una serie de tablas con parámetros y proporciones muy concretas de cada uno de los elementos que constituyen la reacción, así como su correcta formulación. El conjunto de dichas tablas imprescindibles para la elaborar cualquier tipo de jabón, es lo que se conoce como tablas de saponificación.
-Un aceite por ejemplo el acido palmitico, muy usado en estas cuestiones, es un ácido graso saturado de cadena larga, formado por dieciséis átomos de carbono. Su nombre químico es ácido hexadecanoico.
CH3-(CH2)14- COOH + NaOH===> CH3-(CH2)14- COO-Na.
+ H2O.
O sea que es una reaccion de neutralizacion, donde el alcali neutraliza al grupo acido dela molecula, transformandose en una sal sodica o sea el palmitato de sodio, que es solido.